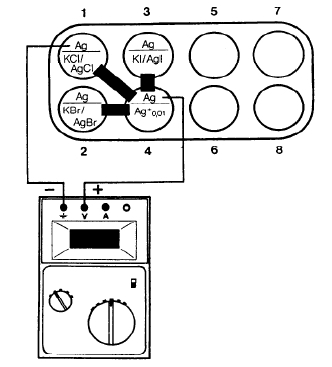
Prinzip
Gibt man in eine 1 molare Kaliumhalogenidlösung (= Kcl, KBr, KI) einige Tropfen einer stark verdünnten Silbernitratlösung (c = 0,01 mol/I), so kommt es sofort zur Ausfällung des entsprechenden Silbe halogenids (AgCl, AgBr, AgI), weil die Löslichkeitsprodukte dieser schwerlöslichen Salze schon durch diese geringen Mengen zugegebener Silberionen überschritten werden. Es bleiben dann nur noch soviele freie Silberionen in diesen Silberhalogenid- lösungen übrig, wie es das Löslichkeitsprodukt KL = c (Ag+) • c (Hal-) zulässt.
Da die Beziehung zwischen Konzentrationsdifferenz und Spannung in einer Konzentrationskette der Nernst-Gleichung folgt, kann man aus der gemessenen Spannung das Löslichkeitsprodukt bzw. die Silberionenkonzentration der jeweiligen Silberhalogenidlösung errechnen, was in diesem Versuch untersucht wird.
Vorteile
- Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit
- Gefährdungsbeurteilung für Schüler und Lehrer erhältlich
- Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur